Etil asetat (Ethyl acetate) ataupun secara sistematiknya,etil ethanoat, biasanya disingkatkan EtOAc atau EA) adalah sebatian organik dengan formula yang CH3COOCH2CH3. Cecair ini tidak berwarna dan mempunyai ciri-ciri bau manis (serupa dengan titisan pir/pear drop) dan digunakan dalam gam, pembuang penggilap kuku, pelarut pembuang kaffein teh dan kopi, dan rokok (lihat senarai bahan tambahan dalam rokok). Etil asetat adalah ester etanol dan asid asetik; ia dihasilkan pada skala yang besar untuk digunakan sebagai pelarut.Mempunyai ketumpatan 0.897g/ml dan takat didih 77.1 °C.
Thursday, December 13, 2012
Mari buat Etil asetat!
Posted by kuro96inlaila at 11:50 PM 2 comments
Friday, February 10, 2012
Atomic theory/teori atom bahagian 1
Apakah itu atom?Bagaimanakah rupanya?
Apakah bahan asas yang membina dunia yang kita lihat tiap-tiap hari?
Itu lah soalan yang bermain di minda manusia sejak beribu-ribu tahun lepas.
Kini hampir 200 tahun sejak manusia betul-betul mendalami ilmu kimia moden.
Teori atom ialah teori keadaan jirim dimana ia menyatakan bahawa semua benda di dalam dunia ni diperbuat daripada sejenis zarah yang dipanggil atom.Atom berasal daripada perkataan Greek,Atomos yang bermaksud "tidak boleh dibelah bahagi".Atom tidak boleh dicipta,dimusnahkan dan dibelah bahagi.
Pada akhir kurun ke-18,dua peraturan telah dibuat tanpa mengambil kira perihal teori atom.Peraturan yang pertama ialah peraturan konservasi jisim (conservation of mass),yang dibuat oleh Antoine Lavoisier pada 1789.Peraturan ini menyatakan bahawa jisim sesuatu reaksi kimia tidak berubah,ini bermakna dalam sesuatu reaksi kimia,berat berat bahan kimia asal sama dengan hasil reaksi kimia tersebut.Peraturan yang kedua pula ialah peraturan nisbah mutlak (law of definite proportions) yang dibuktikan pada tahun 1799 oleh ahli kimia Perancis Joseph Louis Proust.Peraturan ini menyatakan bahawa jika sesebuah sebatian dipecahkan kepada elemen komposisinya,elemen-elemen tersebut akan mempunyai nisbah yang sama.Haih,ntah betul ke tak saya terjemahkan nama peraturan ni.
Kemudian John Dalton mengkaji dan menghasilkan peraturan nisbah berganda (law of multiple proportions).Dalton juga mempercayai bahawa teori atom boleh menerangkan mengapa air menyerap gas karbon dioksida lebih baik daripada gas nitrogen.Hipotesis Dalton mengenai hal ini ialah perbezaan berat dan kerumitan bentuk molekul bahan tersebut mempengaruhi kadar serapan ia terhadap air.Hal ini ternyata benar apabila karbon dioksida didapati lebih berat berbanding gas nitrogen.
Dalton menyatakan bahawa setiap elemen terbentuk daripada atom yang tidak boleh dicipta,dimusnahkan dan dibelah bahagi.Hal ini menandakan teori saintifik pertama berkenaan dengan bahan yang dipanggil atom.
Dalton menganggarkan jisim atom mengikut kadar mereka membentuk sebatian.Tetapi dia tidak mengetahui bahawa sesetengah elemen wujud dalam keadaan molekul seperti O2.
Dia juga tersalah anggap bahawa sebatian yang terdiri daripada dua elemen mengandungi 1 elemen bagi setiap komposisinya,jadi dia menganggap bahawa molekul air ialah HO,bukannya H2O).Hal ini membuatkan carta Dalton mempunyai kecacatan.Jisim oksigen dalam perkiraan Dalton ialah 5.5 kali lebih berat daripada hidrogen,dimana yang sebenarnya oksigen ialah 2 kali lebih berat berbanding hidrogen.
Kecacatan ini diperbetulkan oleh Amedeo Avogadro pada tahun 1811,dimana dia menyatakan bahawa 2 gas yang mempunyai isipadu yang sama pada suhu yang sama dan tekanan yang sama mempunyai bilangan molekul yang sama.(Hal ini membuktikan bahawa jisim zarah sesebuah gas tidak mempengaruhi isipadunya).Peraturan ini membenarkan dia mengkaji ciri-ciri gas diatomik dengan mengkaji jumlah isipadu dimana mereka bertindak balas.Sebagai contohnya,2 liter gas hidrogen bertindak balas dengan 1 liter oksigen untuk membentuk 2 liter wap air.Ini membuktikan bahawa molekul oksigen berpecah untuk menghasilkan 2 molekul air.
Posted by kuro96inlaila at 10:38 PM 3 comments
Thursday, February 2, 2012
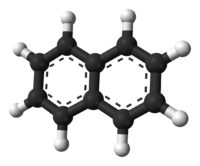
Naphthalene/Naftalena, musuh paling dibenci lipas.
Hm,da lame tak update blog ni.Nampak sangat pemalasnye tuan punye blog,haha.
Internet pon gila-gila sekarang ni,nak wat camner......
OK,up to today's topic.Kalau tengok buku teks kimia tingkatan 4,experiment pertama yang kita buat ialah peleburan dan penyejukkan naftalena.Kita nak cerita pasal naftalena,iaitu bahan kimia organik berformula C10H8.Ia berbentuk serbuk kristal putih berbau unik yang boleh dikesan dengan kepekatan serendah 0.08 ppm berdasarkan berat.Sebagai molekul hidrokarbon aromatik,molekulnya berbentuk cincin benzin yang dicantumkan bersama.Naftalena menjadi bahan utama di dalam ubat gegat.Bahan yang kita selalu letak kat tandas untuk menghalau lipas.
Posted by kuro96inlaila at 9:53 PM 4 comments